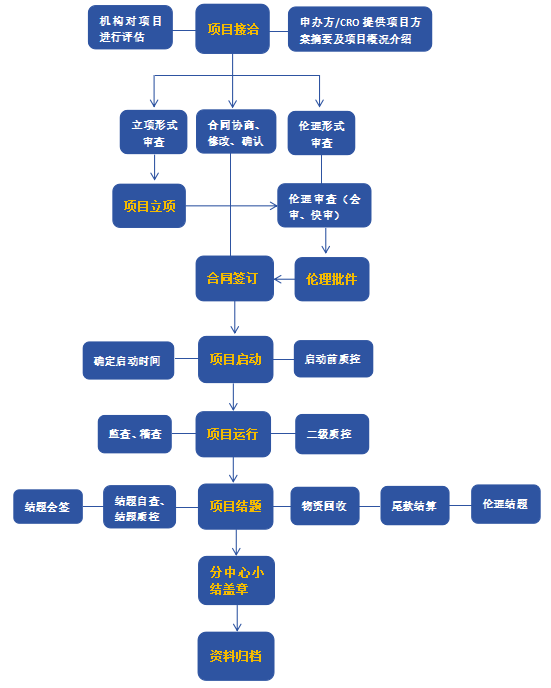
一、項目洽談
將項目方案摘要及項目概況介紹(如項目名稱、申辦方、CRO、SMO、組長單位、組長單位PI、是否取得國家局批件/組長單位倫理批件、全國計劃入組例數、本中心計劃入組例數、是否為競爭入組等)發送至機構辦郵箱(zeyygcp@163.com)。3個工作日內機構辦給出是否承接的回復。同意承接后,請申辦方依據附件1填寫開通臨床試驗管理系統(CTMS系統)賬號所需信息表,并發送至機構辦郵箱,機構辦秘書將依據該信息為申辦方相關人員開通CTMS系統賬號。如申辦方需咨詢、獲取其他信息,可通過郵件或電話聯系機構辦彭老師,電話:0371-85510057倫理秘書侯老師,電話:0371-85510156。
二、立項審核
申辦方在CTMS系統上按照系統要求上傳立項所需資料(所需資料清單見附件2,3),機構辦秘書對資料進行完整性和有效性的審核。立項審核所需時間:3個工作日。
三、倫理審查
遞交立項資料時可同步遞交倫理審查資料,資料清單見附件4。倫理會議審查頻次,1次/月,如項目對時間有特殊要求,可聯系倫理秘書商議。
四、協議簽署
合同審核與倫理審查同步進行,項目各相關方對協議內容進行商議、修改、確認,簽訂協議(協議模板見CTMS--通知/公告)。協議簽署所需時間約為半個月~1個月。
五、項目啟動
完成啟動前質控(啟動前質控表見CTMS--通知/公告),在CTMS完成啟動預約(按預約附件資料清單上傳附件,暫無法獲取的資料如授權分工表,啟動會結束后補充完善),與PI和機構辦公室商定啟動會具體時間,將會議日程表發送至機構辦郵箱或彭老師微信。
六、項目質控
在首例入組、入組50%及入組結束時進行科室一級質控(科室質控檢查表見CTMS--通知/公告),同時項目CRA在CTMS系統預約機構首例質控、中期質控、結題質控。機構質控中發現的問題CTMS形成質控報告,機構及CRA積極督促研究者整改,2周內遞交整改反饋報告。
七、項目結題
清點剩余藥物 、物資,申辦者 /CRO及時對剩余藥物、物資進行回收;CRA完成結題自查(結題自查表見CTMS--通知/公告);完成項目第三方稽查;完成機構結題質控;完成項目尾款結算(尾款結算明細表見CTMS--通知/公告);完成結題確認會簽表(結題確認會簽表見CTMS--通知/公告);分中心小結表CTMS審核同意后紙質版遞交機構辦公室申請蓋章。
八、資料歸檔
CRA將項目資料按照機構歸檔目錄(目錄清單見CTMS--通知/公告)整理后遞交至機構辦公室,機構文檔管理員審查歸檔資料的完整性,按機構管理SOP完成歸檔。
九、各項流程對接人
接洽、立項、合同、啟動:彭詩榮
質控、結題、經費:張國蘭
藥品管理、資料歸檔:張會芬